|
Il corpo indivisibileApprofondimento sulla natura dell'atomo e sul concetto di orbitaleCome abbiamo visto, l'atomo è stato chiamato così perché in passato si riteneva non fosse possibile suddividere questo oggetto in parti ancora più piccole. Anche se questo è stato dimostrato essere falso, l'atomo mantiene una dignità tutta particolare in chimica, poiché il suo assetto è estremamente identificativo nei confronti delle sostanze: cambiare anche uno solo dei suoi componenti ha influenze grandissime sulle sue proprietà, sulle caratteristiche energetiche, sul modo con cui esso può reagire con altri suoi simili.
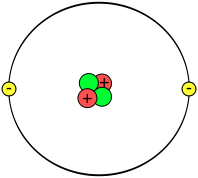
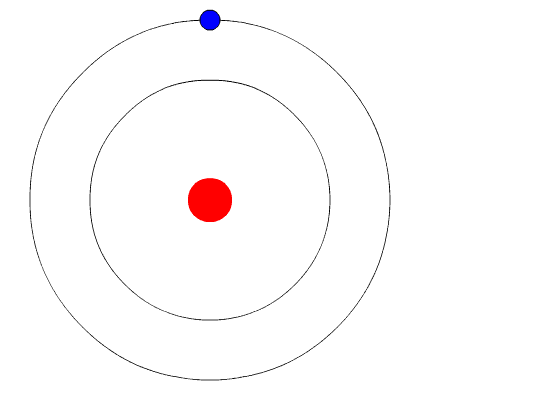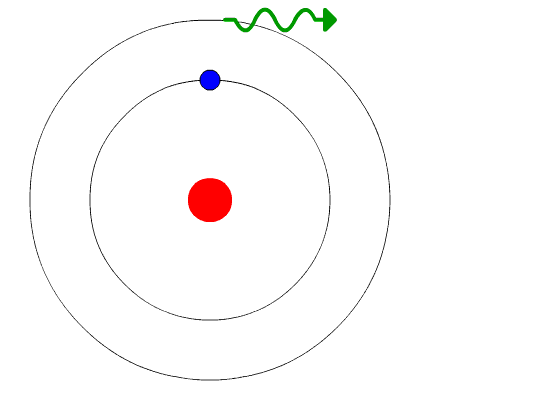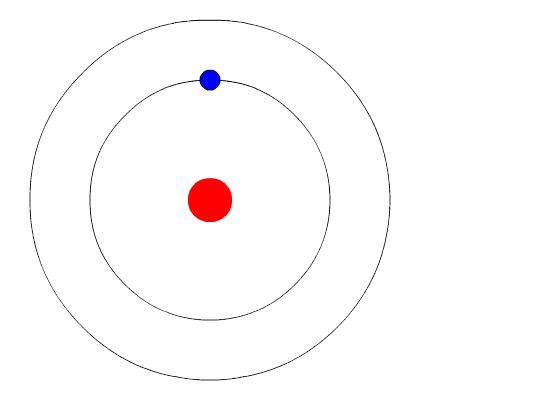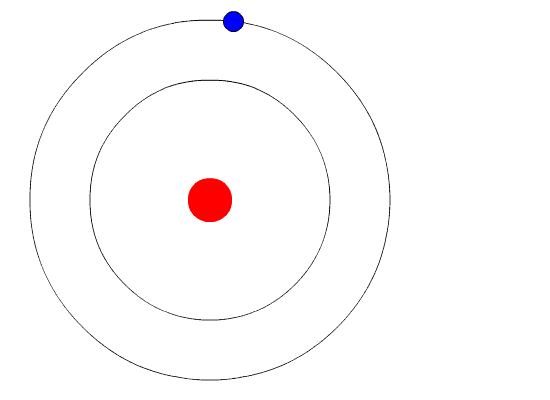
Schema di un atomo di elio L'esperimento di Rutherford del 1910 fu un aspetto chiave della definizione dell'atomo: un sottile foglio d'oro venne bombardato da particelle alfa, ossia nuclei di elio, oppure ancora atomi di elio privi di elettroni. Già si sapeva che l'atomo aveva un'istanza carica negativamente ed un'altra di segno opposto, ed è noto dall'antichità che cariche di segno uguale si respingono. Rutherford ed i suoi allievi supposero che, se il foglio d'oro fosse stato anche a livello microscopico così come lo vediamo nel mondo macroscopico, cioè pieno e continuo, le particelle alfa molto energetiche avrebbero interagito in modo distruttivo con la lamina. L'esito dell'esperimento fu invece inaspettato: la quasi totalità delle particelle sparate verso di essa attraversava l'ostacolo senza variare la traiettoria, mentre solamente un 1% veniva deviato in modo netto. Rutherford scrisse in seguito: <<era quasi altrettanto incredibile che vederci rimbalzare addosso un proiettile da 380 mm, dopo averlo sparato contro un pezzo di carta velina>>.
Differenza fra l'aspettativa ed il risultato dell'esperimento di Rutherford: Come si sa, nella scienza ogni teoria è buona fino a che non viene ritenuta insufficiente a spiegare i fenomeni che appaiono con gli esperimenti. Rutherford riuscì a mettere in luce qualcosa di davvero innovativo, che andava a scontrarsi con l'idea di un atomo sferico, materiale e rigido come una palla di cannone in miniatura, riempito di cariche. Così, propose un nuovo modello atomico, quello basato sui pianeti: l'atomo è costituito, nel suo volume, prevalentemente dal vuoto; al centro, in uno spazio ridottissimo, si trova il nucleo, di carica positiva, attorno al quale ruotano su lunghe distanze gli elettroni carichi negativamente. L'esperimento di Rutherford era così spiegato: essendo prevalentemente "vuoti", gli atomi lasciavano passare tutte le particelle alfa, tranne quelle poche che avevano proprio quelle traiettorie dirette verso i nuclei, carichi dello stesso segno, e quindi venivano fortemente deviate se si avvicinavano troppo ad essi.
Modello atomico di Bohr: le orbite hanno distanze fissate, perché l'elettrone può ricevere solo certi "quanti" di energia Prima di affrontare l'idea di atomo scaturita dall'interpretazione di Copenaghen, dal luogo in cui Niels Bohr e Werner Heisenberg collaborarono per costruire le basi della meccanica quantistica, tentiamo di mostrare perché l'atomo è effettivamente divisibile. Se l'atomo è composto da un nucleo e da elettroni, esso non è più indivisibile: è possibile separare, almeno in teoria, gli elettroni dal nucleo a cui essi sono vincolati. Questo avviene anche nella pratica e si chiama ionizzazione: è possibile staccare elettroni dagli atomi, se si fornisce il giusto quantitativo di energia, e poi fare in modo che gli elettroni svincolati vadano ad interagire con nuclei di atomi neutri. L'energia da fornire per questo tipo di processi non è neanche irraggiungibile, perché essa è di natura elettromagnetica (si basa sul fatto che ci sono cariche di segno opposto che si attraggono) e la natura offre molte occasioni per controbilanciare questa spesa energetica con un guadagno a posteriori. Ricordiamo che nel Modello standard, il mediatore dell'interazione elettromagnetica è il fotone, di cui ce n'è larga abbondanza nell'universo: attraverso gli scambi di fotoni fra atomo e l'ambiente, si può trasferire energia in quantità comparabile con quella in gioco fra elettrone e nucleo, permettendone eventualmente il distacco. Può sorgere la domanda spontanea: se le cariche di segno uguale si respingono, come fanno i nuclei, fatti di cariche positive o tutt'al più nulle, a rimanere uniti? Per quanto riguarda le interazioni elettromagnetiche certamente i protoni si respingono, ma nel nucleo entrano in gioco forze a raggio più corto, ma molto più intense, che vengono appunto chiamate interazioni forti, mediate da particelle chiamate gluoni (da glue, in inglese colla). Queste forze non solo tengono insieme i nucleoni, cioè i componenti "pesanti" protoni e neutroni, ma si trovano anche all'interno di essi, perché i loro componenti fondamentali (i più piccoli di cui oggi si ha conoscenza), ossia i quark, vengono mantenuti "incollati" a tre alla volta proprio da queste medesime forze. Spiegare nel dettaglio la natura degli esperimenti utilizzati per identificarli o le proprietà delle particelle previste dal Modello standard va oltre gli scopi di questa trattazione, ma mi sento di suggerire ai più curiosi la lettura di QED (Quantum Electro-Dynamics), libro dell'illustre Richard Feynman, che oltre a spiegare in modo estremamente valido e chiaro i fondamenti dell'elettrodinamica quantistica, espone alla fine del libro anche qualche idea su questi "frammenti" di atomi.
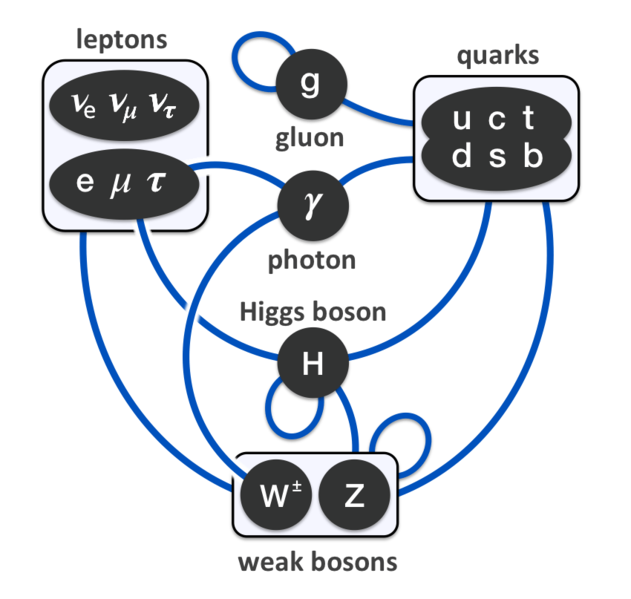
Schema riassuntivo delle varie interazioni fra particelle elementari, secondo il Modello standard Queste osservazioni hanno origine dai lavori degli anni intorno alla metà del Novecento, e hanno come base gli studi dell'inizio del secolo citati sopra: torniamo quindi a dove eravamo rimasti, e riprendiamo l'oggetto della nostra attenzione, l'atomo. In quel periodo si ebbero grandi contributi da parte di celebri scienziati. Fra i passi avanti notevoli del periodo ricordiamo:
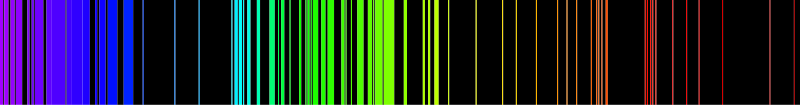
Due esempi di spettri di emissione: sopra per l'idrogeno, sotto per il ferro Rispondiamo, con prudenza, a queste domande: Bene, consci del fatto che quella passata non è altro che un'introduzione, vediamo da dove si parte (sempre in modo semplificato e discorsivo) per definire gli orbitali atomici. La fisica, e dunque la chimica, si avvalgono del concetto matematico di funzione d'onda Ψ per descrivere il moto dell'elettrone intorno al nucleo. Bisogna sempre avere bene in mente questi presupposti: l'elettrone non è un oggetto tanto quanto non è un'onda, è un insieme di entrambe le cose, pertanto localizzare l'elettrone e dire che "esso si muove intorno a ..." è un modo per esprimere un concetto secondo la nostra normale sensibilità, come i pianeti girano intorno al sole. Abbandoniamo dunque qualsiasi preconcetto, perché le particelle si comportano in quel modo indipendentemente dal fatto che siamo in grado di capirlo o meno. Gli elettroni in realtà non hanno alcuna preferenza per un percorso prestabilito, essi si muovono intorno al nucleo, e tutto ciò che possiamo dire del loro moto è racchiuso nella funzione d'onda. L'equazione di Schrödinger, fondamentale per la chimica, afferma: HΨ = EΨdove Ψ è la funzione d'onda, E è l'energia associata all'elettrone in moto, H è l'operatore hamiltoniano, che, nella sua forma indipendente dal tempo, è composto da un termine di energia cinetica (derivata seconda della funzione d'onda nello spazio per una costante) e da un termine di energia potenziale. Sappiamo inoltre che nella meccanica quantistica, il quadrato di una funzione che descrive il comportamento di una particella fornisce la densità di probabilità che la particella si comporti secondo il modello previsto: nel nostro caso Ψ2, il quadrato della funzione d'onda, rappresenta la densità di probabilità di trovare l'elettrone. Ora vedremo come utilizzare queste informazioni. Quando si dice: "particella nella scatola" o "buca di potenziale" si intende una situazione in cui la particella (l'elettrone nel nostro caso) risulta costretta in una regione di spazio ben definita. Se lo spazio è considerato monodimensionale, la particella rimarrà sempre sullo stesso segmento, se lo spazio è bidimensionale, la particella rimarrà sempre sullo stesso piano, se lo spazio è tridimensionale, la particella rimarrà sempre nello stesso spazio (volume).
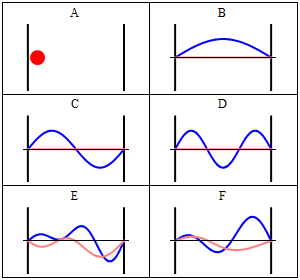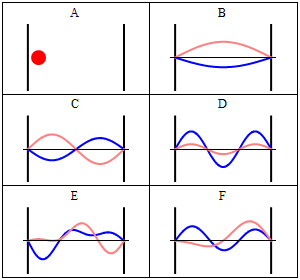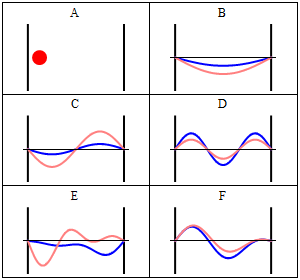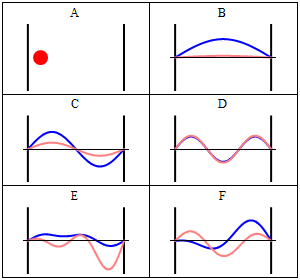
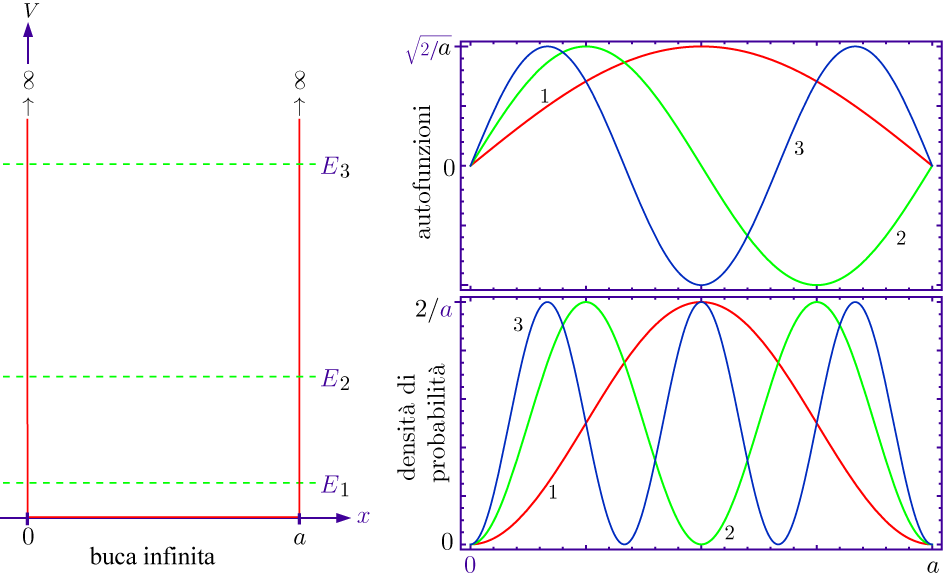
Particella nella scatola (monodimensionale) secondo la visualizzazione classica di Newton Questo è un modello da cui partire per considerare l'elettrone vincolato al nucleo. Abbiamo che ovunque la particella si muova il potenziale è uguale a zero, mentre dalle pareti in poi il potenziale è infinito. Il suo livello energetico non consente di uscire da quella situazione, e nessuna forza agisce su di essa. Per Newton la particella ha uguale probabilità di trovarsi ovunque nello spazio permesso (caso A), mentre con Schrödinger si può facilmente vedere che Ψ risulta nulla in ogni punto in cui il potenziale è infinito. Dove il potenziale è nullo, invece, l'equazione di Schrödinger diventa un'equazione differenziale del secondo ordine, che può essere risolta a patto di fissare alcune condizioni sulla particella all'interno della scatola: 1 - Ψ deve essere una funzione continua Soluzione di quest'equazione differenziale è una funzione in seno che dipende, oltre che dall'ampiezza della scatola, anche da un parametro n in modo che si verifichi il fenomeno visto nei casi B, C e D della figura, cioè che Ψ sia un'onda stazionaria. Nel caso B, n = 1, nel caso C, n = 2, nel caso D, n =3. Ricavando l'energia E dall'equazione di Schrödinger, dopo aver ottenuto la soluzione, si ha un'espressione del tipo: E = (h2/8mL2) * n2dove h è la costante di Planck, m è la massa della particella in questione, L è l'ampiezza della scatola ed n è il nostro fantomatico numero intero, che, fra l'altro, non può essere 0, per ovvi motivi. Il numero n è appunto il numero quantico che si cercava: esso infatti influisce sulla funzione d'onda e sull'energia associata, rendendo quest'ultima "quantizzata" nel senso che i valori di energia sono solamente multipli di un valore minimo, quello dove n = 1. Avendo esaminato una scatola monodimensionale, si è ricavato un solo numero quantico, ma ne occorre uno per ogni grado di libertà della particella, quindi nello spazio tridimensionale è necessario specificare tre numeri quantici per identificare una particella.
Nella figura appena presentata, certamente un po' affollata di informazioni, possiamo distinguere tre esempi di livelli energetici, corrispondenti ai casi n = 1, n = 2, n = 3. Se le Ψ assumono i valori che si vedono nel grafico in alto a destra, il loro quadrato, cioè le densità di probabilità, si comportano nel modo visto nel grafico in basso a destra. Ogni punto in cui la funzione d'onda si annulla si chiama nodo: la particella non passa MAI per quel punto perché la probabilità di trovarla lì è nulla. Sorge spontanea la domanda: come fa un elettrone a spostarsi da un punto all'altro dello spazio (da un picco all'altro della funzione d'onda) se non può trovarsi nello spazio che li congiunge? Semplicemente, questo avviene perché l'elettrone non è solo un oggetto che deve materialmente passare, ma è anche un'onda. Riporto l'esempio del mio libro di Chimica Inorganica: una corda di una chitarra che vibra, perché è stata sollecitata, manifesta di essere attraversata da un'onda, ma dove si trova quest'onda? Su tutta la corda, non in qualche punto di essa, e così fa anche l'elettrone vicino al nucleo: si trova ovunque, non in qualche punto. Interessante è il fatto che aumentando n, e quindi aumentando l'energia, aumentano i picchi di densità, ed essi si avvicinano reciprocamente. Se n tende ad infinito, avremo una distribuzione praticamente continua da un estremo all'altro, perché i picchi saranno talmente fitti che non riusciremo più a distinguere i punti in cui la probabilità è massima da dove è minima.
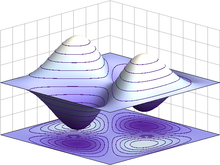
Quando la funzione d'onda e quindi la scatola si trovano in due dimensioni, questo è l'aspetto di una possibile configurazione. Poiché il nostro spazio si estende su tre dimensioni, si utilizzano tre numeri quantici per definire le proprietà della funzione d'onda. Già da qui possiamo immaginare come essi identifichino gli orbitali atomici, ma procediamo nell'analisi. Un approccio più conveniente allo studio della funzione d'onda è quello che prende in considerazione le coordinate polari della particella nello spazio piuttosto che le sue coordinate cartesiane. Scomponiamo dunque Ψ in tre parti: Ψ = R(r) * Θ(θ) * Φ(φ)dove R(r) è la componente radiale in cui r è il raggio (distanza elettrone-nucleo); Θ(θ) è la componente angolare di latitudine, Φ(φ) è la componente angolare di longitudine, θ e φ sono i rispettivi angoli. Lo studio degli orbitali va condotto a partire dalla situazione più semplice, quella dove c'è una sola particella: per questo si considera l'atomo di idrogeno (1 protone -> 1 elettrone) per evitare che altre particelle interferiscano con quella di interesse. Nell'atomo di idrogeno, l'energia (che viene convenzionalmente considerata di segno negativo quando si parla di stato legato) è inversamente proporzionale al quadrato del numero quantico principale n. Questo vuol dire che i valori di energia crescono e si avvicinano a 0 con andamento parabolico, non lineare, ossia in prossimità dello 0 (stato non-legato, elettrone completamente libero) i livelli energetici si infittiscono gradualmente. Una particella in una scatola può assumere qualsiasi combinazione di numeri quantici, ma nell'atomo di idrogeno questo non è possibile. I numeri quantici sono concatenati nel modo seguente: n, numero quantico principale, è un numero intero che parte da uno e cresce all'infinito (n = 1, 2, 3, ...); l, numero quantico angolare, può assumere valori interi da 0 fino a n - 1 (l = 0, 1, 2, ..., n - 1); ml, numero quantico magnetico, può assumere valori da -l a +l (ml = -l, ..., -2, -1, 0, 1, 2, ..., l). Quindi se n = 1 c'è una sola configurazione possibile, se n = 2 ce ne sono quattro in totale, se n = 3 ce ne sono nove, e si procede all'infinito.
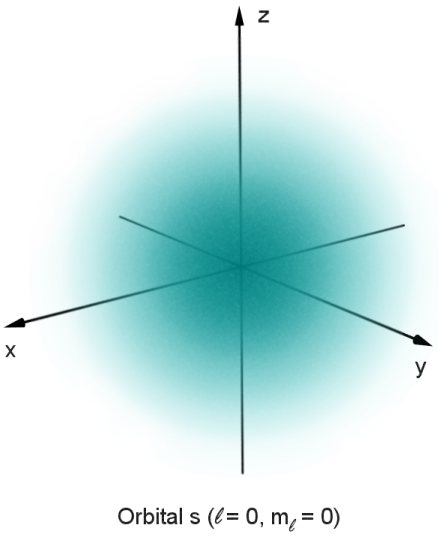
Un orbitale s (cioè con l = 0) non ha componenti angolari e quindi è equivalente in tutte le orientazioni. L'orbitale 1s (n = 1, l = 0), inoltre, non ha nodi, presenta il massimo in una regione compresa fra il nucleo e l'infinito. Al crescere di n, aumentano i nodi radiali, cioè si creano strati concentrici dove il segno della funzione d'onda cambia ad ogni strato, ed in mezzo agli strati la probabilità di localizzare l'elettrone è nulla.
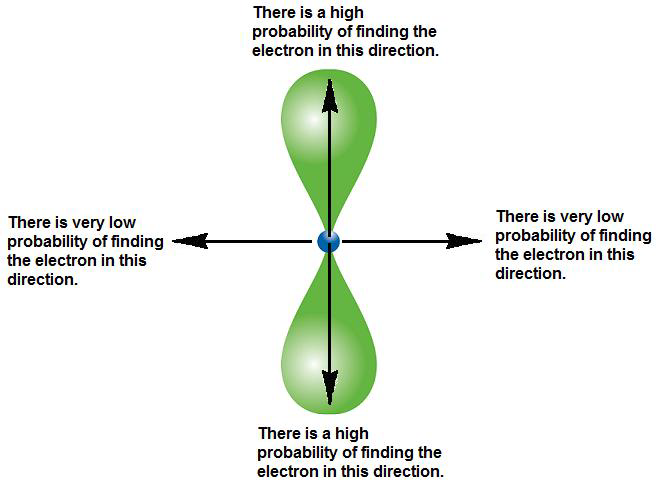
Un orbitale p, invece, ha anche le componenti angolari, che vanno ad influire sulla forma finale, bilobata, dell'orbitale. Questo tipo di rappresentazioni delimitano un volume tale da garantire una probabilità del 95% di trovare l'elettrone al suo interno. L'orbitale 2p non ha nodi, mentre il 3p ne ha uno, il 4p ne ha 2, ...
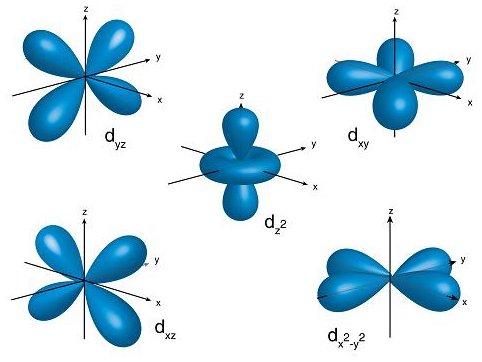
Le cinque forme degli orbitali d Gli orbitali d, che hanno 5 possibili forme, sono quadrilobati: i 3d non hanno nodi, i 4d ne hanno uno, ...; i nodi radiali sono infatti n - l - 1. L'orbitale che apparentemente è quello più strano, con un toro complanare agli assi x e y, il dz2 ha quella forma perché risulta dalla combinazione lineare di due orbitali che non esistono, il dz2-y2 ed il dz2-x2. Gli orbitali f, invece, hanno 8 lobi e hanno forme più complesse. In totale sono 5 e cominciano ad avere nodi da n = 5. Sappiamo che vale il principio dell'Aufbau, che comprende la regola di Hund ed il Principio di esclusione di Pauli: ossia bisogna riempire gli orbitali con elettroni a partire dal livello energetico più basso, quello con n = 1, perché tutti i sistemi tendono a disporsi in modo da minimizzare l'energia. Essendo il livello con n = 1 quello che ha E più bassa (ricordiamo che E è negativo ed inversamente proporzionale al quadrato di n) è l'orbitale 1s, e poi si procede ad occupare quelli con energia più alta, facendo attenzione, in caso di orbitali degeneri (cioè con uguale energia), ad occupare prima tutti gli orbitali con un solo elettrone, lasciando quindi gli elettroni spaiati, e poi completando con un secondo elettrone che abbia numero quantico magnetico di spin ms opposto a quello già posizionato. Quindi per ogni orbitale ci possono essere al massimo due elettroni, ed ogni elettrone è identificato in modo univoco da quattro numeri quantici (del quarto tralasciamo la descrizione dettagliata, e semplifichiamo qualitativamente dicendo che è una proprietà intrinseca dell'elettrone). Qui è importante vedere quali sono gli orbitali ad avere la stessa energia: se l'energia dipende da n2, possiamo pensare di avere orbitali tutti degeneri a parità di n. Questo è vero per tutti gli atomi idrogenoidi, cioè l'idrogeno e tutti quelli che hanno un solo elettrone, indipendentemente dal numero di protoni nel nucleo. Quindi: fornendo sufficiente energia ad un elettrone solitario in un atomo, questo può salire al livello 2 venendo ospitato indipendentemente dagli orbitali s o p, oppure al livello 3 occupando indipendentemente gli s, p o d. Va tenuto bene a mente questo fatto perché in tutti gli altri atomi, che hanno più di un elettrone, cioè la quasi totalità, si perde invece la degenerazione a parità di livello, e quindi si scindono gli orbitali s da quelli p, da quelli d, da quelli f, cioè si originano dei sottolivelli energetici che non sono più tutti equivalenti. Per questo, in generale, gli atomi preferiranno occupare prima quelli s, poi i p, ... sempre rispettando il criterio di minimizzare l'energia, che conta alcune deviazioni dal trend regolare. Quindi, negli atomi polielettronici, anche il numero l gioca un ruolo nell'energia, mentre ml non influisce mai in questo senso. Ricapitolando quindi, in generale per tutti gli atomi: Questo è il modello di atomo che oggi è comunemente ritenuto valido, perché si presta benissimo a descrivere tutti i fenomeni osservabili in natura ed in laboratorio.
|
Joomla! 1.5.14