L'atomo e la teoria atomicaLa materia è organizzata in unità fondamentali, che sono dette atomi, dal greco "che non può essere divisa", perché in passato si riteneva fosse la particella più piccola, e dunque indivisibile, in cui può essere scomposta la materia. Un atomo è una struttura composta da altre particelle, dette subatomiche, che lo identificano in modo univoco. Atomi dello stesso tipo (vedremo adesso nel dettaglio) sono identificativi degli elementi chimici puri, mentre aggregati di atomi formano le molecole. Più elementi insieme formano un composto, mentre più atomi formano una molecola; la molecola formata da atomi uguali rimane un elemento, mentre se gli atomi sono diversi (eteroatomi) si ha un composto.
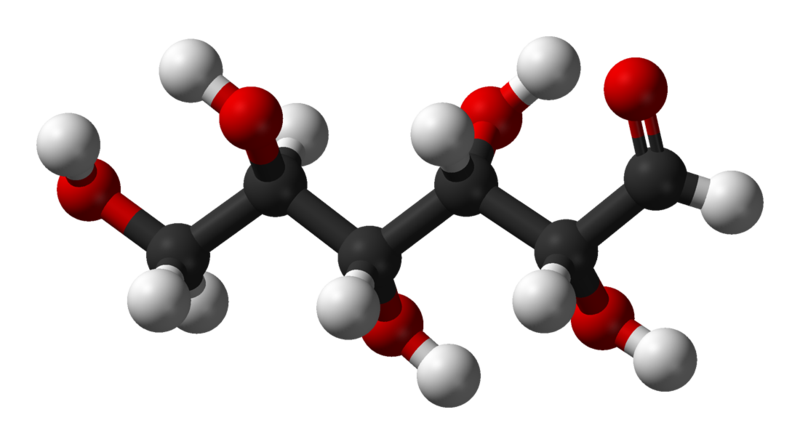
Figura 1: Molecola del glucosio, le palline rappresentano gli atomi, Si può parlare di molecola solo quando gli atomi che lo compongono sono legati fra loro (cioè si aggregano) in un certo modo, perché per altre sostanze, come ad esempio il sale da cucina, non si hanno molecole ma unità di formula, in quanto si tratta di strutture regolari i cui componenti sono legati in modo omogeneo e costante. In pratica, si possono contare le molecole d'acqua, ma non si può contare il sale perché è un'"impalcatura" che si può dividere in tanti modi. La teoria atomica ha subìto nel corso dei secoli modifiche ed aggiustamenti, soprattutto grazie alla crescita graduale di disponibilità di strumenti tecnologici che potessero rispondere a certe domande. Già dall'antica Grecia, i filosofi ritenevano che la materia potesse essere composta da queste particelle molto piccole ed indivisibili. Fra questi, sono da citare Democrito (V - IV secoli a.C.) e Lucrezio (I secolo a.C.) a Roma.
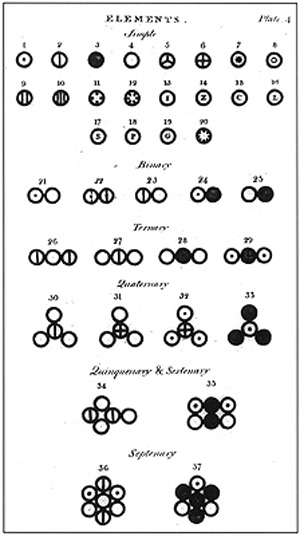
Figura 2: Atomi e molecole secondo John Dalton Solo nell'Ottocento fu ripresa con successo la teoria democritea, grazie a J. Dalton, il cui contributo fu assai importante. Nel suo libro, la teoria atomica era esposta in cinque punti: - la materia è formata da microscopici atomi, indivisibili ed indistruttibili; Oggi, che si è compresa meglio la natura degli atomi, è noto che alcuni di questi punti non sono veri. Secondo J. Thomson, l'atomo si trattava di una sfera piena positiva dove particelle negative rimanevano incastrate nel suo volume, rendendolo globalmente neutro (modello a panettone). Le ricerche condotte da E. Rutherford, invece, dimostrarono sì la presenza di un settore positivo ed uno negativo, ma scoprì che l'atomo è per la maggior parte "vuoto", nel senso che le particelle negative stanno intorno ad un nucleo positivo, e qui nacque il modello planetario, come i pianeti che orbitano intorno al sole. I successivi studi, dimostrarono impossibile il fatto che le particelle negative "orbitassero" regolarmente intorno ad un nucleo senza collassare su di esso (per motivi elettromagnetici), così si passò ad un modello più avanzato, quello dei quanti di energia, secondo il quale queste particelle negative si trovano a livelli energetici ben definiti, a distanze regolari dal nucleo, e che ogni scambio di energia fra le particelle e l'ambiente può provocare il trasferimento da un livello all'altro, non graduale e continuo, ma discreto. Con gli studi di N. Bohr, la meccanica quantistica di M. Planck, il principio di indeterminazione di W. Heisenberg, il contributo di E. Schrödinger, si è arrivati alla moderna ed attuale concezione dell'atomo che esporremo qui di seguito.
Composizione dell'atomo, numero atomico, isotopiL'atomo è formato da tre tipi di particelle subatomiche: protoni, neutroni ed elettroni. I protoni (p+) sono particelle che hanno massa circa 1 unità di massa atomica, corrispondente a circa 1,66 × 10-27 kg, carica elettrica positiva e spin 1/2. [Nota: lo spin è una proprietà delle particelle che si può assumere come momento angolare intrinseco, anche per particelle non dotate di massa, e in modo semplificato richiama l'idea di una rotazione della particella intorno al proprio asse.] Protoni e neutroni costituiscono il nucleo e quindi vengono chiamati nucleoni, mentre gli elettroni viaggiano intorno ad esso. Anche se la quasi totalità della massa si concentra nel nucleo, lo spazio che gli elettroni occupano intorno ad esso è molto grande, paragonabile a quello di una mosca (nucleo) al centro di uno stadio (zona degli elettroni). Il numero atomico (Z) è il conteggio dei protoni, ed è identificativo dell'atomo. Affinché questo numero cambi è necessario ricorrere a reazioni nucleari, non comuni nella quotidianità. Atomi con stesso numero atomico ma diverso numero di massa sono detti isotopi, come ad esempio l'idrogeno pròzio, deuterio e trizio; carbonio-12, carbonio-13 e carbonio-14. Per essere neutro, l'atomo nello stato fondamentale deve contare stesso numero di protoni ed elettroni. Poiché gli elettroni sono molto più piccoli, quindi leggeri e mobili, solo questi possono essere scambiati con le energie che abbiamo solitamente a disposizione, perché i protoni rimangono nel nucleo. Quando questo accade, si forma uno ione, cioè un atomo che ha assunto una carica dopo aver acquistato o ceduto un elettrone. Di un certo interesse è il raggio atomico, che si potrebbe semplificare come il raggio di una sfera, se considerassimo l'atomo come tale, e ne indica quindi la grandezza. Gli atomi sono veramente molto piccoli, e di fatto 18 soli grammi di acqua distillata, ossia 18 mL, contengono 1 mole, cioè 6,022 × 1023 molecole d'acqua, ognuna contenente due atomi di idrogeno ed uno di ossigeno. Un numero molto alto: seicentoduemila miliardi di miliardi.
Orbitali e numeri quanticiIl comportamento di un elettrone intorno al nucleo è in realtà molto complesso e non si può identificare come un semplice viaggiare su orbita circolare o ellittica come avviene per i nostri pianeti in campo gravitazionale. Molti esperimenti e teoremi matematici hanno contribuito a costruire un nuovo capitolo della scienza all'inizio del '900 che cerca di spiegare cosa succede nel microscopico: è ciò che chiamiamo meccanica quantistica. In meccanica quantistica si postula che il comportamento di un elettrone sia descritto interamente da una funzione d'onda (wavefunction). Si tratta di una funzione complicata, perché tiene conto delle coordinate di tutti gli elettroni, che soddisfa l'equazione di Schrödinger (vedere approfondimento sopra). Al giorno d'oggi, è possibile risolvere esattamente questa equazione solamente per un elettrone, quindi, ad esempio, per l'atomo di idrogeno. Si ottiene così un set infinito di funzioni, e ciascuna di queste descrive l'elettrone in un particolare stato: le funzioni così ottenute vengono chiamate orbitali. Il principio di indeterminazione di Heisenberg esclude che si possa conoscere contemporaneamente velocità e posizione degli elettroni in un atomo, quindi ai nostri occhi gli elettroni si muovono in modo casuale in uno spazio intorno al nucleo. Si tratta comunque di uno spazio abbastanza ben definito, che si può rappresentare graficamente sfruttando immagini degli orbitali a tre dimensioni. Gli orbitali sono chiaramente funzioni, ma ricorreremo spesso ad un lessico del tipo "orbitali occupati dagli elettroni", come se gli orbitali fossero contenitori, in analogia con pianeti ed orbite oppure con palline e scatole, questo perché risulta molto intuitivo immaginare gli elettroni localizzati in certe posizioni e questo consente di proiettarci nella realtà chimica e la reattività. Bisogna comunque fare sempre attenzione a ricordare che gli orbitali sono funzioni che spiegano "come" l'elettrone si muove, e non esattamente dei contenitori. La funzione d'onda non ha un vero significato fisico, ma l'elevamento al quadrato del suo modulo (perché in generale le funzioni d'onda sono complesse) fornisce la densità di probabilità di trovare l'elettrone in un determinato punto. Facendo l'integrale su tutto lo spazio del modulo quadro si ottiene 1, cioè la certezza di trovare l'elettrone nello spazio.
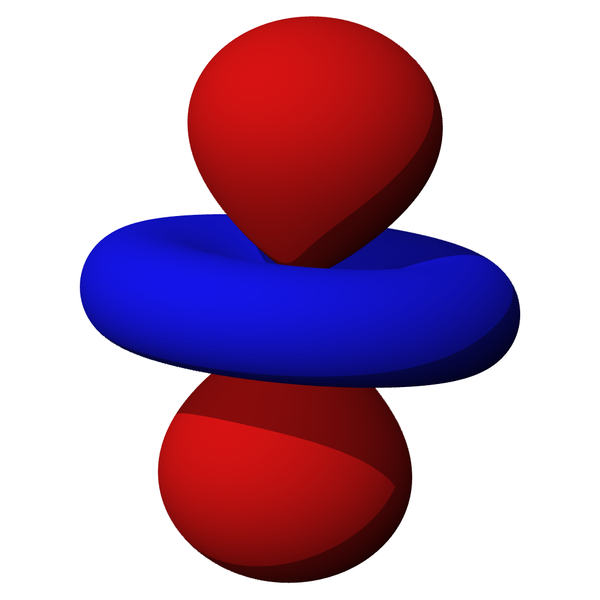
Figura 3: Rappresentazione pittorica di un orbitale del tipo 3d: dz2 Non si può dire esattamente dove si trova l'elettrone ma si può delineare una superficie delle funzioni con un'alta densità di probabilità. Sui libri di scuola, in modo un po' ingenuo e non del tutto corretto, si assume l'orbitale come una zona dove si ha alta probabilità (in genere fissata a 95%) di trovare l'elettrone. L'orbitale non ha confini, è una funzione su tutto lo spazio, ma è utile visualizzare queste figure, che sono molto riconoscibili ed utili per spiegare la chimica. La meccanica quantistica insegna due cose importanti: Gli orbitali quindi hanno diverse forme e dimensioni a seconda del livello energetico che l'elettrone assume, possono cambiare segno (da positivo a negativo) e quindi passare anche per lo 0. Se un orbitale, in un certo punto, assume il valore 0, allora si ha un nodo, e non è possibile che l'elettrone si trovi in quel punto, in quanto la densità di probabilità è nulla. Un nodo può anche essere una retta, un piano, o una superficie sferica, ma è comunque una zona in cui il valore della funzione d'onda si annulla. Se due atomi si avvicinano, ad esempio due atomi di idrogeno, questi faranno interagire i loro orbitali in modo crescente. Dall'ottica sappiamo che onde che interferiscono possono interagire in modo costruttivo, ed amplificarsi, oppure in modo distruttivo, e quindi sopprimersi. Questi due comportamenti possibili vengono determinati da diversi fattori, per il momenti basta immaginare che nel primo caso si ha una situazione di legame (si forma una molecola), nel secondo caso gli atomi si respingono. L'interazione positiva si ha quando due orbitali hanno lo stesso segno, cioè anche quando si affacciano due zone negative, mentre si ha una situazione di antilegame quando si affacciano orbitali di segno opposto. Abbiamo parlato solo di orbitali nel caso di un solo elettrone, perché questo è l'unico che è possibile risolvere esattamente con l'equazione di Schrödinger. Come si fa per tutti gli altri atomi, che sono la maggioranza? Semplicemente si utilizzano delle approssimazioni utili per i nostri scopi, e nel caso in cui dovessimo rappresentarli graficamente per spiegare certe reazioni chimiche utilizziamo direttamente le soluzioni dell'atomo di idrogeno anche per atomi multielettronici. Vediamo ora come si classificano gli orbitali: ogni orbitale viene identificato da tre numeri detti numeri quantici: - il numero quantico principale (n), assume valori interi a partire da 1 (esempio: n = 1, 2, 3, ...) ed ha a che fare con l'energia dell'orbitale, la sua grandezza, ed il numero totale di nodi; Per il principio di esclusione di Pauli, un massimo di due elettroni possono essere ospitati in un orbitale. Questi due elettroni devono avere, per forza, valore di spin opposto. Si può allora utilizzare un orbitale per ospitare due elettroni e si suddivide questo orbitale in due spin-orbitali separati, uno per l'elettrone con spin +1/2 (spin α) ed uno per l'elettrone con spin -1/2 (spin β). Questi due spin-orbitali vengono distinti da un quarto numero quantico, il numero quantico magnetico di spin (ms), che può essere +1/2 oppure -1/2. Quindi, per localizzare in modo univoco un elettrone di un atomo, si possono dare in sequenza i quattro numeri quantici che caratterizzano il suo orbitale, ad esempio n=2, l=0, ml=0, ms=+1/2. Questi numeri, che identificano quel particolare elettrone, forniscono informazioni riguardo la sua energia, la sua posizione e molte altre cose. Tutti gli orbitali di tipo l=0 si chiamano s (dalla parola sharp) e hanno forma sferica, tutti quelli di tipo l=1 si chiamano p (dalla parola principal) e hanno forma bilobata, tutti quelli del tipo l=2 si chiamano d (dalla parola diffuse) e hanno forma quadrilobata, e tutti quelli del tipo l=3 si chiamano f (dalla parola fundamental), dalle forme complesse. Questi sono i tipi di orbitali che vengono occupati dagli elettroni degli atomi che noi conosciamo oggi, anche se in teoria esisterebbero infiniti tipi per numeri di l ancora maggiori. La nomenclatura prosegue in ordine alfabetico dopo f, quindi per l=4 si avrebbero gli orbitali g, per l=5 gli orbitali h, e proseguendo così fino alla z, evitando tuttavia la lettera j.
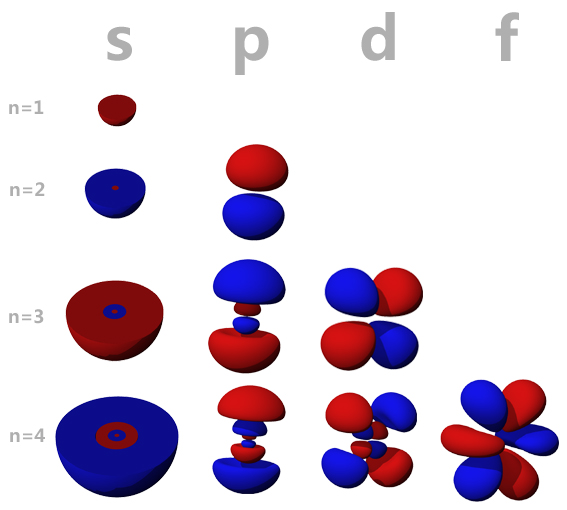
Figura 4: Alcuni orbitali a partire da n=1 fino a n=4. La crescita di n contribuisce anche all'aumento di complessità Il numero principale indica il livello energetico, chiamato anche guscio (shell), il numero angolare indica il sottolivello (subshell). Il livello più alto occupato da elettroni viene anche chiamato livello o guscio esterno, per il fatto che quelli a più alta energia, se sono occupati, comprendono in volume anche quelli più piccoli (ulteriori informazioni in Tedesco sugli orbitali atomici s e p, vedete su ChemgaPedia, cliccando su -weiter- per procedere nella lettura) Quindi, tenendo conto del principio di esclusione di Pauli, risulta che nel primo livello (n=1) trovano posto due elettroni, nel secondo livello (n=2) altri otto elettroni, cioè due in ciascuno dei quattro orbitali, nel terzo livello altri diciotto elettroni, e così via. Il modo con cui gli elettroni si sistemano nei vari orbitali è regolato, e l'assetto di elettroni in un atomo è chiamato configurazione elettronica, che vedremo ora.
Principio dell'Aufbau e configurazione elettronica
Principio dell'Aufbau: gli elettroni si posizionano, quando l'atomo è nel suo stato fondamentale, a partire dagli orbitali ad energia minore, lasciando per ultimi quelli ad energia maggiore. Risulta evidente che possono esserci anche diversi livelli completamente vuoti, a seconda del numero di elettroni, e quindi di protoni, dell'atomo.
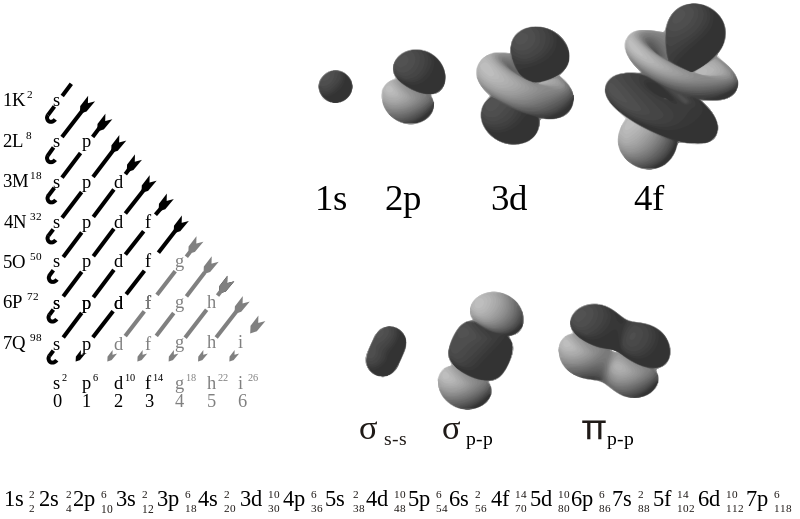
Figura 5: Ordini di energia di livelli e sottolivelli Nell'immagine qui sopra, abbiamo diverse informazioni interessanti: - in alto a sinistra abbiamo l'ordine in sequenza con cui vengono riempiti gli orbitali. In verticale, 1K, 2L, 3M, ..., sono i nomi dei livelli energetici (numero principale), mentre in orizzontale, s, p, d, ..., sono i sottolivelli (numero angolare). Seguendo la freccia, si ottiene la sequenza scritta sotto. - sotto, la sequenza fa capire che ci sono dei "salti" fra livelli, ma questo è indicativo del fatto che alcuni orbitali di livello più basso sono più energetici di altri a livello più alto. Il numero ad apice fra un termine e l'altro indica quanti elettroni sono sistemabili in quell preciso sottolivello; il numero a pedice invece è la somma degli elettroni di quel livello più tutti quelli precedenti, come conteggio totale. - in alto a destra ci sono quattro esempi di orbitali atomici, sulla prima riga, e tre esempi di orbitali molecolari (fusioni fra orbitali atomici di diversi atomi che servono affinché si generi un legame fra atomi). Quindi, ad esempio, il carbonio, che ha 6 protoni, avrà nel suo stato fondamentale lo stesso numero di elettroni, che si sistemeranno così: Lo stato fondamentale è lo stato a più bassa energia, che rispetta le regole spiegate in questa sezione. Gli stati a più alta energia rispetto a quello fondamentale vengono detti stati eccitati, e hanno naturalmente energia variabile a seconda di come vengono disposti gli elettroni, se con elettroni spaiati, appaiati, in orbitali ad alta energia o solo di un sottolivello più in alto. Il principio di Pauli è comunque sempre rispettato. Tutto questo, solitamente, si indica attraverso una rappresentazione a quadratini e freccette (indicative dello spin degli elettroni):
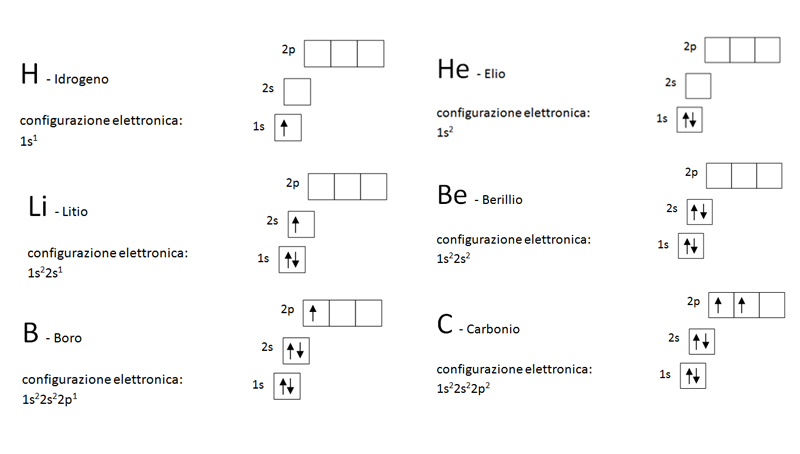
Figura 6: Configurazioni elettroniche dei primi sei atomi nello stato fondamentale. Questo apre una strada sicura alla classificazione degli atomi: infatti quelli che hanno lo stesso numero di elettroni di valenza (cioè quelli esterni), ovvero aventi gli elettroni posizionati nello stesso modo in sottolivelli corrispondenti, hanno proprietà simili. Ad esempio carbonio, silicio, germanio, stagno, piombo e flerovio hanno tutti due elettroni nel sottolivello p. Per questo, è opportuno impostare un sistema ben organizzato per poterli classificare nel modo più efficiente: la tavola degli elementi (prossima pagina).
|
Joomla! 1.5.14