|
Assicuratevi di aver completato la lettura della prima pagina, prima di procedere! La tavola periodica degli elementi
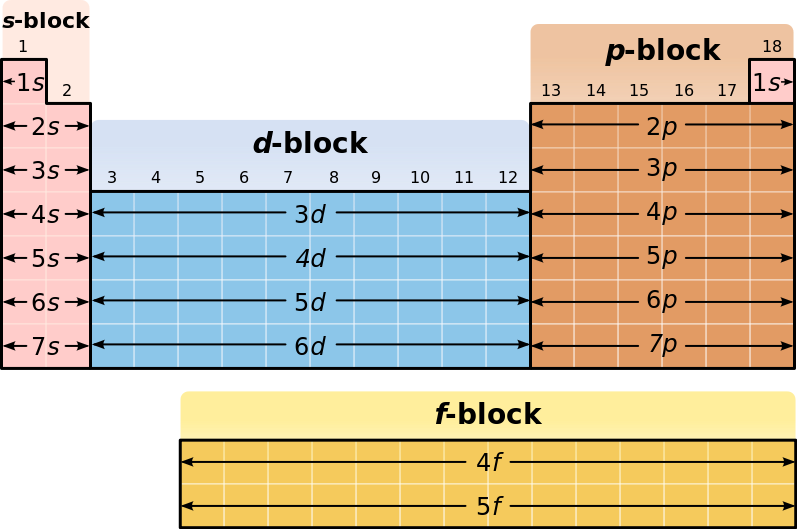
nelli'immagine: Tavola periodica degli elementi di Mendeleev, clic su di essa per ingrandire La tavola periodica degli elementi per antonomasia è quella progettata inizialmente dallo scienziato russo D. Mendeleev. Essa serve a classificare gli elementi conosciuti in un modo molto efficiente, questo perché la posizione di ogni elemento è assai significativa. La posizione degli elementi è determinata dalla loro configurazione elettronica, ed in particolare il loro ordine consiste nel numero atomico crescente, quindi, partendo dall'atomo con un solo protone si ha l'idrogeno (H, 1), quello con due protoni, l'elio (He, 2), quello con tre, il litio (Li, 3), e si procede così fino a raggiungere i numeri oltre il centinaio. Gli elementi sono elencati con il numero atomico crescente verso destra. Ogni riga della tavola si chiama periodo, mentre ogni colonna si chiama gruppo. Si può pensare che gli elementi sulla stessa riga siano quelli più simili fra loro, mentre invece le proprietà periodiche (cioè che appunto si ripetono di volta in volta) si riscontrano sugli atomi in verticale, quelli del gruppo. Quindi sono molto più simili carbonio (C, 6) e silicio (Si, 14) di quanto non lo siano carbonio ed azoto (N, 7). Ci sono finora 18 gruppi verticali e 7 periodi. I vari "pezzi" che la compongono, ad esempio la colonna a sinistra, il ponte centrale, il corpo a destra, le righe sotto, sono chiamati blocchi e prendono il nome dal tipo di orbitale che gli elementi fanno occupare: i gruppi 1 e 2 fanno parte del blocco s, i gruppi dal 13 al 18 fanno parte del blocco p, i gruppi dal 3 al 12 fanno parte del blocco d, quelli che sono chiamati in questa tavola gruppi 19 e 20 fanno parte del blocco f. Nella vecchia denominazione, ancora tradizionalmente usata, gli elementi dei gruppi 13, 14, 15, 16, 17 e 18, quelli cioè del blocco p, venivano individuati come elementi dei gruppi 3, 4, 5, 6, 7 e 8. Per ovviare al problema di sovrapposizione di nomi, si usavano eventualmente i numeri romani e le lettere A e B per distinguere quelli del blocco p e del blocco d, ad esempio gruppi IIIA, IVA, VA, ..., per il blocco p e IIIB, IVB, VB per il blocco d, ma forse la nuova denominazione crea meno confusione.
nelli'immagine: i blocchi e la corrispondenza periodo - livello energetico Abbiamo detto che le caratteristiche degli elementi sono simili in verticale, e che gli atomi sono ordinati per numero atomico, ma in che modo? Ancora nomenclatura! Tradizionalmente, i chimici hanno assegnato nomi "comuni" ai gruppi o a certe sequenze di elementi. Sono segnalati in grassetto e sottolineato quelli che sono effettivamente usati spesso: -- gruppo 1, escluso H: sono chiamati metalli alcalini (alkali metals); -- gli elementi del sesto periodo appartenenti al blocco f si chiamano lantanòidi (prima lantànidi, ora sconsigliato; lantanoids) dal lantanio (La, 57) al lutezio (Lu, 71); * Una bellissima versione di una tavola periodica dinamica è consultabile qui: sfogliate le varie schede per maggiori informazioni sugli elementi. *
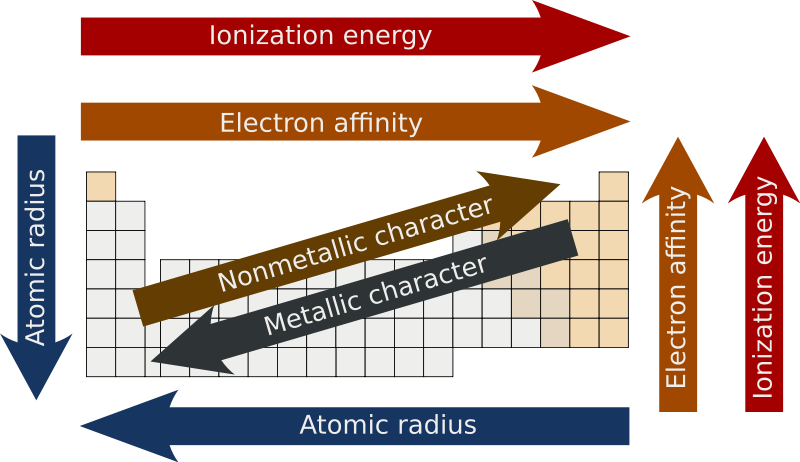
Le proprietà periodicheIn generale, gli elementi della tavola hanno proprietà ricorrenti o caratteristiche che è bene tener presente. Intuitivamente, al crescere del numero atomico (quindi al crescere della quantità di particelle subatomiche) vi è un aumento di dimensioni dell'atomo. Infatti, gli atomi aumentano di dimensioni scendendo lungo il gruppo, avendo nubi elettroniche più sviluppate. Tuttavia, al contrario di quanto si possa pensare, il raggio atomico diminuisce lungo il periodo. Questo avviene perché, essendoci un numero maggiore di protoni a destra rispetto a sinistra, gli elettroni risentono maggiormente di forze attrattive nei confronti del nucleo, anche se sono di più, e quindi la nube elettronica si contrae. Dunque, il raggio atomico aumenta nel gruppo e diminuisce nel periodo. Abbiamo detto in precedenza che gli atomi possono perdere o acquistare elettroni, compatibilmente con gli orbitali e gli elettroni disponibili. Se l'atomo ha pari numero di elettroni e protoni si dice che è neutro. Se acquista un elettrone, c'è un avanzo di carica negativa e lo ione ottenuto sarà un anione, se invece cede l'elettrone, si ha un avanzo di carica positiva e lo ione ottenuto sarà un catione. Ora, tenendo presente che gli atomi, individualmente, tendono a mantenere lo stato neutro, cioè a tutelare un equilibrio di cariche complessivo, risulterà evidente che bisogna fornire energia per far sì che un elettrone si stacchi dall'atomo: c'è attrazione fra elettrone e nucleo, e quindi bisogna "faticare" per allontanare la carica negativa. Lo stesso sembrerebbe valere per l'acquisto di un elettrone, mentre invece la maggior parte degli elementi libera energia quando gli si fornisce un elettrone in più. L'energia di prima ionizzazione, cioè l'energia richiesta a separare dall'atomo e portare all'infinito il primo elettrone del sottolivello esterno, è maggiore per gli elementi che tendono a ricevere elettroni piuttosto che a cederli: si farà molta meno fatica a "strappare" un elettrone ad un atomo che tende a cederli. Poiché gli elementi più pesanti hanno molti elettroni, i loro elettroni più esterni saranno meno attratti dal nucleo (effetto di schermaggio) e quindi più facilmente separabili. Pertanto l'energia di ionizzazione diminuisce lungo il gruppo ed aumenta lungo il periodo. L'affinità elettronica, cioè l'energia liberata quando si aggiunge un elettrone ad un atomo, chiaramente aumenta negli atomi che tendono ad acquistarne, ed è molto bassa per gli atomi che tendono a cederne, addirittura alcuni hanno energia con segno opposto per indicare che invece bisogna fornirne per far sì che questo avvenga. Pur avendo andamento meno regolare, l'affinità elettronica diminuisce lungo il gruppo ed aumenta lungo il periodo. Per tenere conto contemporaneamente di questi due trends, che esprimono due punti di vista di uno stesso aspetto, si è pensato di creare un parametro che riunisse energia di ionizzazione ed affinità elettronica (una specie di media fra i valori): questa è l'elettronegatività, proposta nel 1932 da L. Pauling, misurata con una scala che porta il nome di questo scienziato. Riflette la tendenza ad acquistare gli elettroni: gli alogeni sono quelli ad averla più alta. L'elettronegatività diminuisce lungo il gruppo ed aumenta lungo il periodo. A volte ci si riferisce al contrario dell'elettronegatività come elettropositività. Questo è anche legato al carattere metallico già prima annunciato: gli elementi a maggior carattere metallico (riassumibile sinteticamente come il fatto di avere caratteristiche tipiche dei metalli più pronunciate) sono in basso a sinistra, mentre quelli a maggior carattere non-metallico sono in alto a destra. In questo contesto, l'idrogeno, avente un solo elettrone, ha proprietà fondamentalmente intermedie, perché può cedere un elettrone per diventare protone, o acquistarne uno per avere la configurazione dell'elio, gas nobile subito adiacente.
nelli'immagine: trends (tendenze) più importanti del sistema periodico
per qualche cenno in più sull'elettronegatività
Informazioni storiche- La tavola periodica attuale è riconosciuta a Dimitrij Mendeleev (1834 - 1907), chimico russo insignito di diversi premi, il cui nome è stato dato ad un elemento fra gli attinoidi, il mendelevio (Md, 101). Egli infatti propose la sua prima tavola nel 1869.
- In realtà, già Julius L. Meyer (1830 - 1895, a sinistra), chimico tedesco contemporaneo di Mendeleev (a destra nell'immagine), aveva proposto nel 1864 una tavola degli elementi messi in ordine per la valenza (cioè il numero di legami che solitamente formano), ma era incompleta.
- Nell'immagine sopra, la tavola periodica originale di Mendeleev. Gli elementi sono ordinati in base alla massa atomica e posizionati in modo da presentare orizzontalmente valenze uguali, ad esempio, secondo questo layout:
Nella prossima pagina vedremo come ed in che modi gli atomi si rapportino fra loro per dare le molecole.
|
Joomla! 1.5.14